
药物名称:Vadadustat
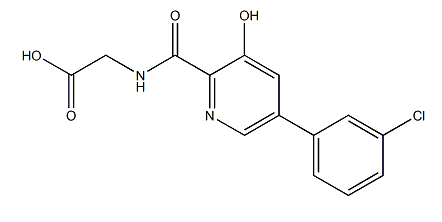
CAS: 1000025-07-9
靶点和IC50:hypoxia-inducible factor prolyl hydroxylase (HIF-PH)
适应症:贫血
开发公司:Akebia
开发状态:2020年5月5日Akebia Therapeutics宣布Vadadustat全球3期治疗透析成人肾脏疾病引起的贫血达到顶级结果。
药物名称:umbralisib
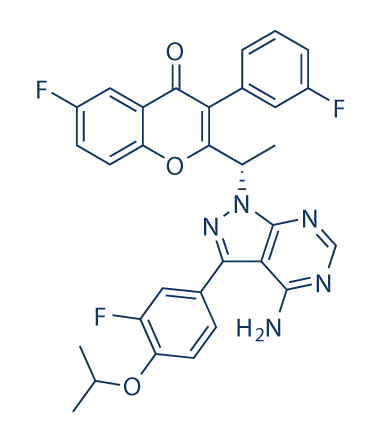
CAS:1532533-67-7
靶点和IC50:PI3Kδ,22.2 nM
适应症:慢性淋巴细胞性白血病
开发公司:TG
开发状态:2020年5约5日TG Therapeutics宣布UNITY-CLL三期临床研究(评估Umbralisib和Ublituximab(U2)联合治疗慢性淋巴细胞性白血病)达到阳性顶线结果。
药物名称:secnidazole
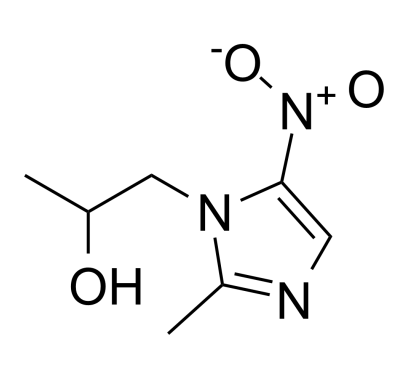
CAS:3366-95-8
靶点和IC50:
适应症:滴虫病
开发公司:Lupin
开发状态:2020年5月4日Lupin公司宣布其单剂量Solosec®(secnidazole)用于治疗滴虫病的三期临床研究取得了阳性顶线结果。计划在2020年下半年向FDA提交补充的Solosec®治疗滴虫病新药申请。
药物名称:Sarizotan


CAS:177975-08-5
靶点和IC50:HTR1A,DRD2
适应症:神经发育疾病Rett综合症
开发公司:Newron
开发状态:2020年5月4日Newron公司宣布Sarizotan治疗神经发育疾病Rett综合症的STARS临床研究评估了疗效,并未显示出主要或次要疗效变量的疗效证据。
Rett综合症是一种严重的神经发育障碍,主要影响女性,估计患病率为10000之一。目前没有批准的治疗方法。 其特征是丧失了获得的精细和粗略的运动技能,以及神经,认知和自主神经功能障碍的发展,这导致人们进行日常活动,行走或交流的能力丧失。 Rett综合症还与预期寿命缩短有关。 Rett综合症患者中约25%的死亡可能与脑干未成熟和自主神经功能衰竭引起的多发性心脏呼吸节律不全有关。这些患者中超过95%的MeCP2基因具有随机突变。在某个时期,大约70%的Rett综合症患者发现呼吸暂停,过度换气和呼吸不正常。
药物名称:QVM149(indacaterol acetate/glycopyrronium bromide/mometasone furoate)
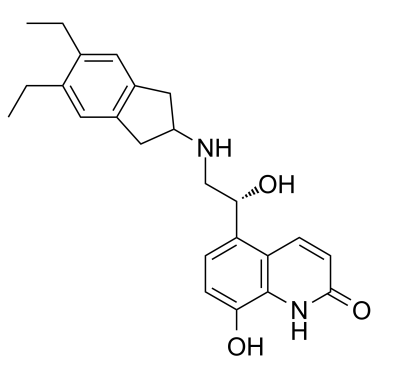
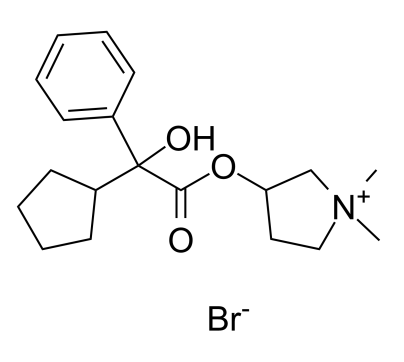
适应症:成人哮喘
开发公司:Novartis
开发状态:2020年5月1日欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,建议批准Enerzair Breezhaler(QVM149;indacaterol acetate/glycopyrronium bromide/mometasone furoate,醋酸茚达特罗/格隆溴铵/糠酸莫米松;IND/GLY/MF),作为一种维持疗法,用于接受长效β2受体激动剂(LABA)和高剂量吸入性皮质类固醇(ICS)组合方案维持治疗未能充分控制病情、且在上一年中经历了一次或多次哮喘急性加重(asthma exacerbation)的哮喘成人患者。
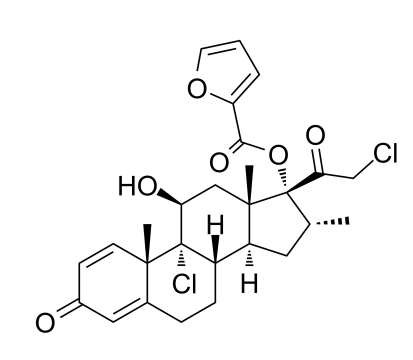
药物名称:Encorafenib
CAS:1269440-17-6
靶点和IC50:0.3 nM (BRafV600E)
适应症:BRAFV600E-突变转移性结直肠癌
开发公司:Pierre Fabre
开发状态:2020年5月1日欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,建议批准Braftovi(encorafenib)与Erbitux(cetuximab,西妥昔单抗)联合用药方案(Braftovi二药方案),用于治疗先前已接受过系统疗法但病情进展(经治)、携带BRAF V600E突变的转移性结直肠癌(mCRC)成人患者。
药物名称:CC-486(口服阿扎胞苷)
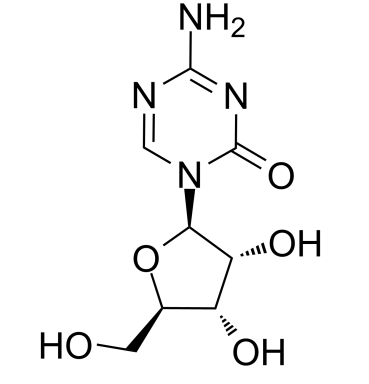
CAS:320-67-2
靶点和IC50:DNMT1,Nucleoside Antimetabolite/Analog,Autophagy
适应症:急性髓性白血病
开发公司:百时美施贵宝(BMS)
开发状态:2020年5月1日美国食品和药物管理局(FDA)已受理CC-486(口服阿扎胞苷)的新药申请,这是一种口服低甲基化剂,用于维持治疗强化诱导化疗后病情处于缓解期的急性髓性白血病(AML)成人患者,具体为:用于在强化诱导化疗(有或无巩固化疗)后实现首次完全缓解(CR)或血细胞计数未完全恢复的完全缓解(CRi)、不适合或选择不进行造血干细胞移植(HSCT)的AML成人患者的维持治疗。FDA已授予该NDA优先审查,并已指定《处方药用户收费法》(PUDFA)目标日期为2020年9月3日。
来源:monkey123456