细胞疗法新“革命”——TCR-T疗法全球研发概览
发布日期:2022年03月15日浏览量:文章来源:药渡网
近年来,肿瘤免疫疗法已经成为了抗癌领域的一大热点,肿瘤免疫治疗实际上分为两大类:
一种把肿瘤的特征“告诉”免疫细胞 ,让它们去定位,并造成杀伤;另一种是解除肿瘤对免疫的耐受/屏蔽作用 ,让免疫细胞重新认识肿瘤细胞,对肿瘤产生攻击(一般来说,肿瘤细胞会巧妙伪装,逃脱免疫的监视)。
第一种情况,因为要利用机体自身的免疫细胞,因此,目前多为免疫细胞治疗; 后一种主要是阻断被屏蔽的免疫信号,因此,多为小分子药物和抗体药物,如大家熟知的PD-1/PD-L1一类。当然,还有其它类别,甚至联合应用效果更好。而第一种情况(免疫细胞治疗)一直是研究的热点,包括LAK、DC、CIK、DC-CIK、CAR-T、TCR-T、NK、CAR-NK以及肿瘤浸润性淋巴细胞(TILs)等等。但是经过十数年的研究,眼下效果出色且最新的是CAR-T和TCR-T这两种细胞治疗方法。目前,多项 TCR-T治疗的临床研究正在开展,现有结果表明TCR-T具有较好的治疗效果,但也存在副作用等问题亟需解决。综上所述,本文将聚焦TCR-T治疗的临床研究进展、目前面临的挑战以及未来发展的方向。
2002年Rosenberg团队率先发现,从黑色素瘤中分离出的肿瘤浸润淋巴细胞(Tumor infiltrating lymphocyte,TIL)经体外扩增回输后,可以 特异性杀伤肿瘤细胞 。但是在其他肿瘤中,TIL往往不易获取且体外扩增时间长,扩增后多为终末分化的T细胞,持续抗肿瘤效果较弱。在这样的背景下,人们探究能否在正常外周血淋巴细胞(Peripheral blood lymphocyte,PBL)上导入已知的抗原特异性TCR基因进行治疗,这便是TCR-T细胞治疗的由来。2006年Rosenberg小组在Science上发表的一篇文章显示,经基因修饰的TCR-T细胞在黑色素瘤的治疗中显示了较好的应用前景——参与试验的17名患者中,有2人出现了抗肿瘤响应,该研究首次证明了基因改造TCR用于肿瘤治疗的可行性。第一代TCR-T是从患者T细胞中分离出肿瘤抗原特异性识别的T细胞亚群,经体外扩增后回输治疗。由于这种T细胞克隆数量极少,个体差异很大,因此很难产业化。
第二代TCR-T是通过克隆上述肿瘤抗原特异性识别的T细胞,获取其TCR基因序列,再转导至患者的外周T细胞上,这种方法使得TCR-T产业化成为可能。第三代TCR-T是通过优化TCR的亲和力,使其能够更好地识别肿瘤抗原,再将其转导至患者T细胞上,整体提高TCR-T的成药性。第四代TCR-T是靶向肿瘤新抗原(neoantigen)的高特异性细胞疗法,肿瘤应答和安全性都大幅提高。
TCR-T的全称是“T细胞受体工程化T细胞疗法”,同属新型细胞免疫疗法。 主要通过基因编辑技术,将能特异性识别肿瘤抗原的T细胞受体(TCR)基因导入患者自身的T细胞内,使其表达外源性TCR,从而具有特异性杀伤肿瘤细胞的活性。T淋巴细胞被誉为人体内的“战士” ,在人体血液、淋巴和周围组织器官发挥免疫功能,能够抵御和消灭肿瘤细胞。但在肿瘤细胞逃逸过程中,T细胞却不能很好地识别杀伤肿瘤细胞。TCR(T cell receptor)是T细胞表面的特异性受体,以非共价键与CD3结合,形成TCR-CD3复合物,通过识别并结合MHC呈递的抗原从而激活T细胞,促进T细胞的分裂与分化。TCR-T疗法是向正常外周血淋巴细胞上导入已知的抗原特异性TCR基因进行治疗的一种疗法。普通T细胞中引入新的基因,使得改造过的T细胞能够表达有效识别肿瘤细胞的TCR,从而引导T细胞杀死肿瘤细胞。
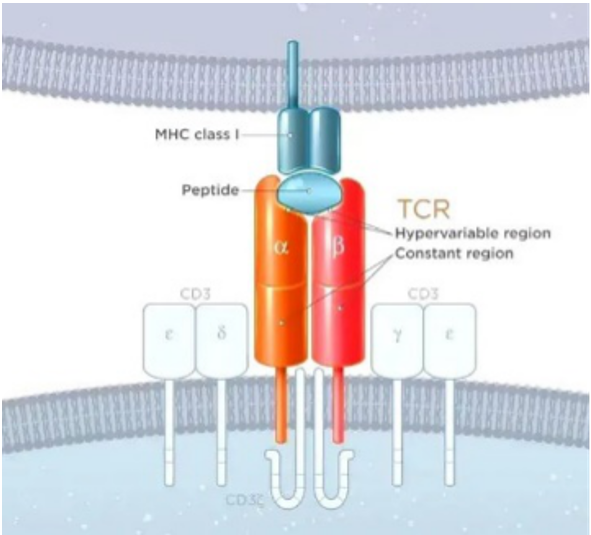
(1).其一在于都是通过基因改造的手段提高T细胞受体对特异性癌症细胞抗原的识别能力和进攻能力,因此都被统称为“T细胞受体重新定向”技术( T cell receptor redirection);(2).其二是治疗流程类似,都是对患者自身的T淋巴细胞进行体外改造,然后回输到患者体内。TCR-T与CAR-T疗法不同之处,就在于对肿瘤细胞的识别机制。 两者虽然都是对患者的T细胞进行体外改造,再回输至患者体内, 但CAT-T依靠的是人工设计的单链抗体片段(CAR) ,只能识别肿瘤表面的抗原,通过胞内共刺激分子传递信号,进而激活T细胞。而 TCR-T则更类似于人体中天然的T细胞 ,主要依靠亲和力优化的或者是纯天然的TCR识别肿瘤MHC分子呈递的抗原,通过TCR-CD3复合物向胞内传递刺激信号 [3] 。因此,TCR-T不光能够识别肿瘤表面的抗原,更能够识别肿瘤内部成百上千个抗原。正是这点,使TCR-T更适合应用于实体瘤治疗。
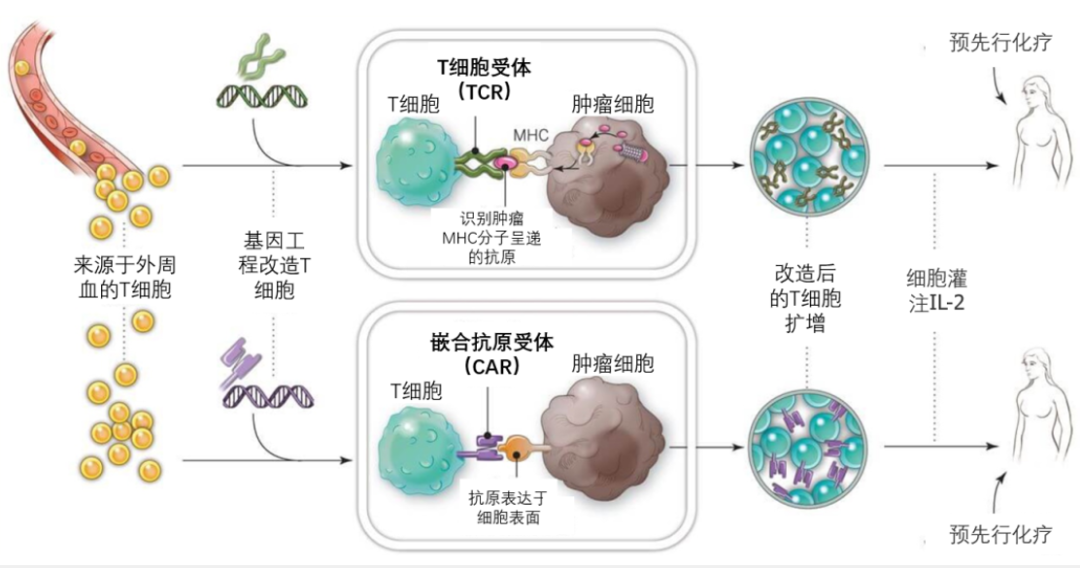
此外,由于CAR-T疗法在临床应用过程中面临的最大挑战就是其毒副作用,如细胞因子释放综合征(CRS)和免疫效应细胞相关性神经毒性综合征(ICANS) [1] 。而TCR-T的TCR更多是天然全人源的,从根本上降低了细胞毒性的风险。
高效的TCR筛选及开发是这个领域共同的挑战。人类肿瘤抗原主要分为两类:肿瘤相关抗原(癌-睾丸 (CT) 抗原、过表达抗原、分化抗原)和肿瘤特异性抗原(新抗原、肿瘤病毒抗原)。虽然TCR-T可以针对所有肿瘤抗原,但目前已经获得证明其安全有效的靶点仍然有限,目前大部分TCR-T临床试验针对的靶点是癌-睾丸抗原和肿瘤病毒抗原,其中最多的是NY-ESO,开发数量占比高达37%,后来者应警惕不要在该靶点上扎推。筛选最佳亲和力阈值的TCR也是一个难点 ,一方面需要尽可能筛选出那些对抗原具有高亲和力的TCR以增强免疫反应,但也需要控制其亲和力,超生理的TCR亲和力会损伤T细胞,对TCR的pHLA结合特性的修饰会导致针对自身抗原不可预测的交叉反应,可能导致严重的不利事件。最新一代针对新抗原的TCR-T技术的挑战在于如何有效识别这类抗原。Kite Pharma公司在细胞群和单细胞层面采用 HTS-IR技术以及TraCeR和单细胞TCRseq等计算生物学方法 ,用于重建TCR和鉴定具有免疫原性的新抗原;国内的泛恩生物和可瑞生物则是利用 流式分选患者肿瘤抗原特异性的T细胞 ,然后利用单细胞技术快速获得识别这类抗原的TCR基因,再将其导入患者外周T细胞用于治疗。这些探索为分析T细胞的多样性、动力学提供了新的工具,更多工具仍需生物信息学技术的进一步开发。除此之外,TCR必须与患者的人类白细胞抗原(HLA)等位基因相匹配才能识别这些pMHC并杀伤癌细胞,所以筛选合适的HLA配型也非常重要,这也是为什么国外的TCR-T不能直接在国内应用的原因之一。TCR-T脱靶产生的毒性反应以及其他不良反应,需要完善的质量验证体系来验证;外源TCR与内源TCR链间的错配所带来的不确定性和安全性风险仍应引起高度关注,目前多种TCR改构策略均各有利弊。TCR 链表达载体的设计、元件的选择、序列的优化等多种方案可作为提高受体表达质量的重要辅助手段。TCR-T产品在生产原材料、生产工艺、过程控制、辅料、包装容器、稳定性等方面与CAR-T 细胞产品有相似之处,在质量评价方面可参考相关的指导原则和考虑要点,如国内《细胞治疗产品研究与评价技术指导原则(试行)》、《细胞治疗产品申请临床试验药学研究和申报资料的考虑要点》及国外如美国FDA和欧盟EMA先进疗法相关的指导原则。TCR-T的生产成本占到TCR-T总成本的近80% ,如何降低生产成本和提高生产产能,对于提高产品上市用于患者的可及性,是非常关键的。在细胞治疗领域,产品定价一直是备受关注、讨论不绝的话题。Kymriah定价47.5万美元/疗程,Yescarta定价37.3万美元/疗程,价格高昂似乎已被看作细胞治疗的标签。成本确实是个问题,但随着市场规模扩大,研发和工艺各个环节上的改善,成本下降是必然趋势,这是整个行业一起努力的方向。肿瘤免疫逃逸是指肿瘤细胞通过多种机制逃避机体免疫系统识别和攻击,从而得以在体内生存和增殖的现象。 实体瘤本身具有复杂的免疫抑制微环境和内在异质性的特点,当前TCR-T诱导持久的反应仍然具有挑战性。参考CAR-T的解决方案:
一是通过修饰T细胞让其释放细胞因子从而抵消肿瘤微环境中的免疫抑制因子;二是与肿瘤微环境(TME,肿瘤微环境中有很多细胞,包括肿瘤细胞、成纤维细胞、免疫细胞、各种信号分子和细胞外基质等,肿瘤微环境显著影响着肿瘤的诊断、生存结局和临床治疗敏感性,不同肿瘤组织的微环境都有着各自的特点)抑制剂联用。
2022年1月25日,Kimmtrak(tebentafusp-tebn)是由Immunocore公司研发的免疫疗法,近日获得美国FDA批准上市。用于 HLA-A*02:01 阳性的无法切除或转移性葡萄膜黑色素瘤(mUM)成人患者。Kimmtrak的获批成就了多个“第一”,成为具有里程碑意义的重大突破:
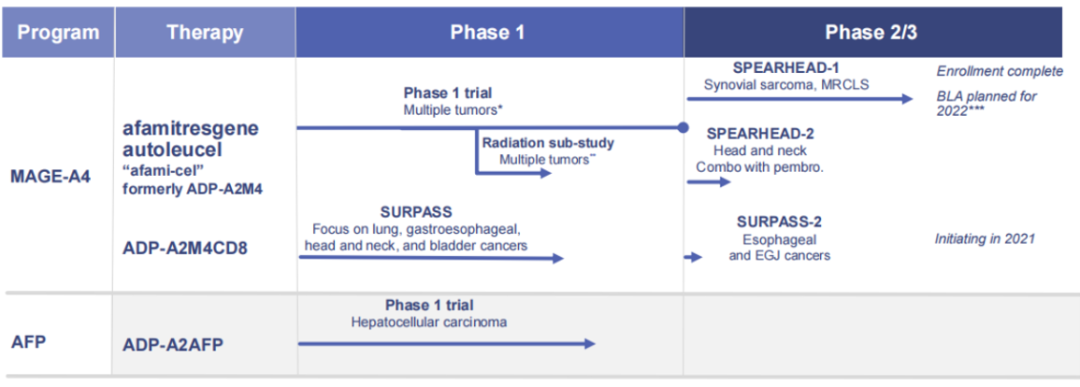
全球TCR-T疗法主要瞄准了实体瘤市场,在国际上已经成为研究的热点。据不完全统计,目前国内外已上市一款产品Kimmtrak,处于临床以上阶段的药物53个,大部分处于I/II期和临床前的早期阶段,适应证包括转移性非小细胞肺癌、肝细胞癌、多发性骨髓瘤、软组织肉瘤、头颈癌、黑色素瘤、脂肪肉瘤、宫颈癌等。Adaptimmune成立于2008年,2015年5月于纳斯达克上市,截至2021年7月30日市值5.55亿美元。公司独特的SPEAR(Specific Peptide Enhanced Affinity Receptor)T细胞平台能通过对T细胞的改造,让T细胞可以靶向和摧毁包括实体瘤在内的多种恶性肿瘤细胞。公司首个产品NY-ESO已经转让给GSK,GSK拥有全球的独家研发和推广权。目前公司产品MAGE-A4处于临床II期,AFP处于临床I期。

Adaptive Biotechnologies成立于2009年,最初的名字为Adaptive TCR Corporation,是一家通过利用适应性免疫系统的固有生物学来改变疾病的诊断和治疗的公司。2019年1月,Adaptive与罗氏旗下的Genentech达成合作。Adaptive将使用其研究性TCR发现平台来筛选患者体内最佳的TCR,Genentech则将根据Adaptive提供的生物信息来设计和制造TCR-T药物,Adaptive Biotechnologies一跃成为了TCR-T领域的明星公司。其拥有的TruTCR筛查平台可通过免疫测序和其他技术来鉴定和表征有效结合靶抗原的TCR。
Medigene成立于1994年,是一家总部位于德国慕尼黑的生物技术公司,致力于开发TCR-T和DC疫苗。
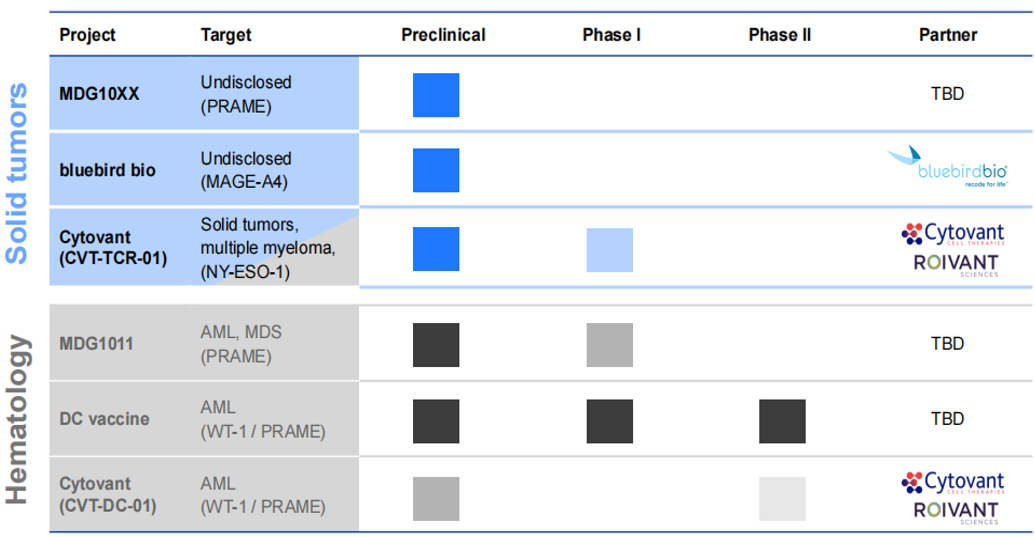
TCR2 Therapeutics成立于2015年,并在当年10月完成了4450万美元的A轮融资,2019年2月纳斯达克上市。公司就像它的名字一样,重点发展TCR疗法。TCR2有一项其独有的技术优势,即TRuCTM平台,优势在于可以不通过HLA匹配,本身就包括完整的TCR复合体。通过将肿瘤抗原结合体如scFV、sdAb和Fab等直接连接到TCR复合体上,新的结构能够在不需要HLA的情况下识别肿瘤细胞表面高度表达的抗原,利用完整的TCR机制来激活T细胞功能。目前公司有一款TCR-T产品处于临床I期试验。
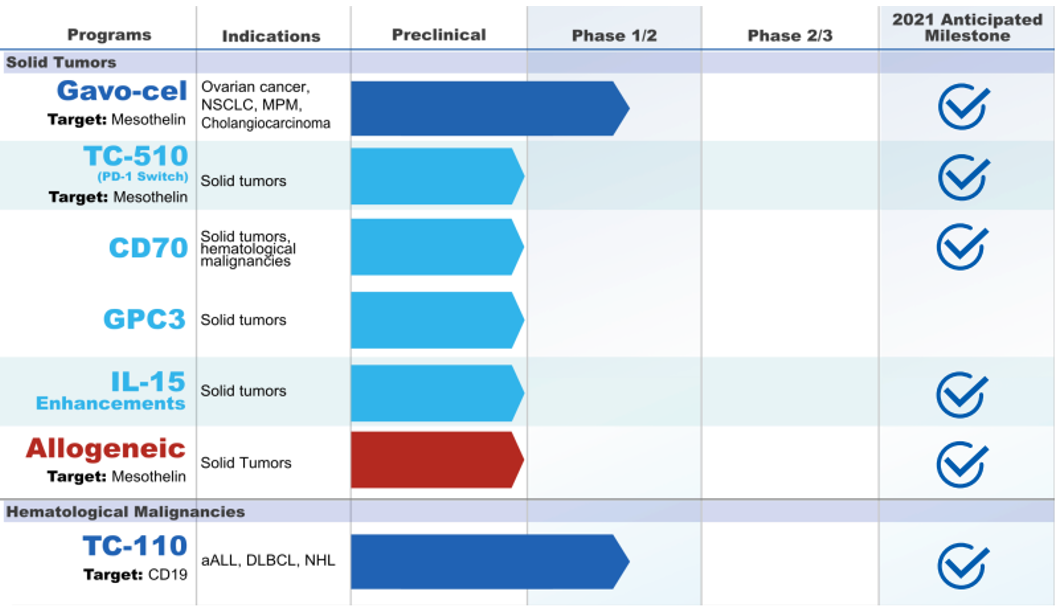
RootPath是一家临床前阶段生物技术公司,利用世界领先的超高通量的DNA片段组装和基因合成技术,率先开发了合成免疫学平台,这一平台使得个体化、多克隆、肿瘤反应性TCR-T治疗成为可能。
1)用多个TCR 避免逃逸;
2)用自体TCR要保证安全;
3)用外周血T细胞作为载体保证T细胞的功能。
RootPath目前主要关注的是中等免疫原性的实体瘤,包括结直肠癌、非小细胞肺癌,头颈癌、胃癌。国内TCR-T临床申请数量位居全球第二,国内布局TCR-T企业有香雪精准、天科雅、可瑞生物、优替济生、深圳因诺免疫、广州来恩生物医药、北京可瑞生物,其中香雪生命的高亲和TCR-T新药TAEST16001已获得国内首个TCR-T临床试验许可。香雪精准医疗技术有限公司(XLifeSc)成立于2015年,是以细胞免疫治疗为切入点,具有国际领先水平的前沿生物技术的医药企业。XLifeSc主要致力于研发具有我国自主知识产权的针对肿瘤的特异性T细胞过继免疫治疗的新方法(TCR-T免疫治疗技术),该技术具有手段创新性、独特性和高效性,达到国际先进水平。XLifeSc已建立了从TCR-T 产品研发、制备、质控、产品产业化到临床转化的全覆盖的研发平台,有覆盖绝大部分群体基因型的产品管线。目前XLifeSc已成功开发了抗原特异性高亲和性T细胞受体转导的自体T细胞疗法(TAEST),第一款产品TAEST16001注射液已获得国家药监局批准进入新药临床试验,是中国首个进入注册制临床试验的TCR-T细胞药品。天科雅专注于肿瘤免疫细胞治疗的研发与产业化,其TCR/CAR-T开发平台,病毒和细胞改造及生产技术平台处于国际领先地位。
1)TRUST平台,使用包括单细胞测序、转录组数据分析等工具,同步分析TCR的转录水平与功能性作用来降低假阳性率,目前公司利用TRUST平台筛选出超过20个新靶点TCR;
2)CHECK-T技术平台,利用病毒改造T细胞。在病毒中加载两条序列,分别表达TCR和对抗肿瘤微环境、减轻免疫抑制的组件,再转染T细胞做成TCR-T产品;
3)TURBO-T应对肿瘤的异质性难题,在TCR-T产品开发中加载肿瘤微环境修复因子,激发体内免疫以对抗肿瘤异质性。
公司第一批进入临床试验的管线针对的是因病毒感染而引发的肿瘤,如EBV、HPV,目前处于IIT阶段。

可瑞生物由多位北大校友和留学归国人员共同创立,致力于抗肿瘤免疫治疗技术的研发、基因编辑产品的开发和服务,以及遗传疾病基因治疗的探索。现有的TCR优化需要经历复杂、繁琐的体外突变文库建立、噬菌体展示和亲和力优化等环节,而且并不能得到最优的治疗性TCR。针对这些瓶颈,可瑞生物发展出了TCR亲和力优化技术SMART-TCR,简化并改进了现有的TCR方案。
1)制备TCR的多样性库;
2)通过阳性选择获得高亲和力的TCR;
3)通过阴性选择排除非特异性的TCR。
公司 于2021年下半年启动“ 晚期宫颈癌TCR-T细胞产品”的患者招募,启动针对结直肠癌/胰腺癌的IIT准备,并有MAGE、AFP和多种靶点的双特异性TCR蛋白药产品在研。优替济生的策略是基于细胞工程技术平台,对T细胞本身进行改造,同时通过反转肿瘤微环境来让TCR-T或CAR-T更好地发挥作用,避免免疫逃逸问题。 公司的核心技术LACO-stim旨在通过反转肿瘤微环境来增强T细胞功能,如将PD-L1/PD-1抑制性免疫微环境的信号转换为T细胞的“第二信号”,不但解除了微环境对T细胞的抑制作用,还使得T细胞具有更强的杀伤能力和更长的持久性。优替济生优先开发的产品选择了四个相对安全的靶点:CD19、NY-ESO-1、Mesothelin、HER2,适应症涵盖血液瘤和实体瘤,产品均处于临床前的药物发现阶段。
Immunocore和Adaptimmune 已经由新锐成长为了领头羊,国内外医药巨头诺华、恒瑞、复星也悄然布局,TCR-T对于实体瘤的效果值得期待,虽然还有不足之处,但随着技术的革新和积累,让我们看到人类距离攻克癌症的那天越来越近。
热门文章推荐
